以转反义硫氧还蛋白基因小麦TY18-99和TY18-100及其相应未转基因对照为材料, 于2007—2009年通过盆栽试验系统研究了反义
To clarify the functional mechanisms of starch accumulation by the antisense-
硫氧还蛋白h (thioredoxin h, Trxh)是一类广泛存在于生物体内的多功能活性蛋白, 它能够通过氧化还原二硫键来参与生物体内的一系列生化反 应[1]。在种子萌发期间, Trxh通过还原小麦水解酶抑制蛋白的双硫键, 促进淀粉酶和蛋白质酶活性、增加贮藏蛋白的水溶性, 动员贮藏物质的水解, 从而促进种子萌发[2,3]。Ballicora等[4]报道, Trxh能还原ADP-葡萄糖焦磷酸化酶, 从而提高它与主要活化剂3-磷酸甘油酸的亲合力, 促进淀粉的合成。Wong等[5]发现花后10 d的小麦种子中, Trxh对与淀粉和蛋白质等合成有关的酶及蛋白质有明显的促进作用。源于蓝色鹝草( Phalaris coerulescens)的硫氧还蛋白 s(thioredoxin s, Trxs)基因与 Trxh基因同属于硫氧还蛋白基因家族, cDNA 序列有较高的同源性, 其蛋白质表达产物有相同的活性中心和相似的生物活 性[6,7]。2003年, 我们将 Trxs基因的反义结构导入普通小麦豫麦18中[8,9]。与对照相比, 转基因小麦的抗穗发芽能力明显提高, 水解酶活性和巯基含量显著降低[10], 而淀粉含量和产量却显著提高[11]。
淀粉是小麦籽粒的主要成分, 约占籽粒重量的70%, 小麦籽粒的灌浆充实过程主要是胚乳中淀粉的合成与积累过程。因此胚乳中淀粉的生物合成及其积累直接关系到小麦的品质和产量。参与淀粉合成的酶主要有腺苷二磷酸葡萄糖焦磷酸化酶(adenosine diphosphorate glucosepyrophorylase, AGPase)、可溶性淀粉合酶(soluble starch synthase, SSS)、颗粒结合型淀粉合酶(granule-bound starch synthase, GBSS)和淀粉分支酶(starch branching enzyme, SBE)等, 它们由相应的淀粉合成酶基因, 即 AGPase、 SSS、 GBSS I、 SBE等所编码。因此, 为了揭示反义 Trxs基因对小麦淀粉品质形成的调控作用及其机理, 本文对转基因和对照小麦籽粒灌浆期淀粉积累、淀粉合成关键酶活性及基因表达进行了分析, 旨在为抗穗发芽转基因小麦在生产上的进一步应用提供依据。
采用基因枪转化法将硫氧还蛋白基因的反义结构(反义 Trxs)导入其受体品种豫麦18中, 经过连续3代以上的自交, 并结合PCR、RT-PCR检测和表型选择, 筛选到目标基因稳定遗传且抗穗发芽的转基因纯合株系TY18-99和TY18-100。将2个转基因株系和未转基因对照品种于2007—2009年连续2个生长季节盆栽于河南农业大学科教示范园区。盆钵直径为30 cm, 深35 cm, 每盆装干土15 kg。土壤为沙壤土, 取自大田0~30 cm耕层, 装土前过筛。每盆施纯N 2.92 g, P2O5 4.04 g, K2O 3.10 g。将盆埋于大田, 盆内土壤与盆外大田土齐平。每处理20盆, 随机区组排列, 3次重复。10月21日播种, 三叶期每盆定苗15株, 整个生育期管理一致。
于开花期选择同一日开花、穗型大小一致的单穗挂牌标记, 于开花后第10天开始, 每隔5 d取一次样, 共取5次。选取标记穗第4至第10小穗基部的2个籽粒, 每次取200粒, 其中100粒在液氮中速冻30 min, 置-80℃冰箱保存, 用于酶活性及基因表达测定; 另100粒于烘箱中105℃杀青30 min, 70℃烘至恒重后用于淀粉含量的测定。
每年记录播种期、出苗期、抽穗期、开花期和成熟期。成熟后每处理取5盆, 分别考察株高、单株成穗数、每穗粒数、结实小穗数、不孕小穗数、千粒重和单株产量。
1.4.1 淀粉含量 采用何照范[12]的双波长比色法, 并作适当改进。其中直链淀粉含量测定的主波长用620 nm, 参比波长用430 nm; 支链淀粉含量测定的主波长用540 nm, 参比波长用720 nm; 总淀粉含量为直链淀粉和支链淀粉含量的总和。
1.4.2 AGPase、SSS、SBE和GBSS活性 参考程方民等[13]的方法提取酶, 略有改动。取样品籽粒15粒, 称重后倒入研钵, 加5 mL提取液[含100 mmol L-1 Tris-HCl, 8 mmol L-1 MgCl2, 2 mmol L-1 EDTA, 12.5% ( V/ V)甘油, 1% ( W/ V)聚乙烯吡咯烷酮(PVP-40)], 研磨成匀浆, 10 000× g, 4℃离心25 min, 分别收集上清液和沉淀, 上清液用于AGPase、SSS、SBE活性测定; 沉淀部分加入5 mL上述提取液, 悬浮后用于GBSS活性测定。
参照Douglus等[14]的方法测定AGPase活性, 参照Nakamum等[15]的方法测定SSS和GBSS活性, 参照赵法茂等[16]的方法测定SBE活性。所有酶活性测定均以等量煮沸的粗酶液为对照, 生化试剂均购自Sigma公司。
取大小均匀一致的冻存籽粒3~4粒提取总RNA[17], 用琼脂糖凝胶电泳鉴定RNA的质量, 以260 nm/280 nm吸光值测定RNA浓度和纯度。
根据GenBank中小麦 Trxh、 AGPase、 SSS、 GBSS、 SBE基因保守区域, 用Primer Premier 5.0软件设计特异引物(表1), 由北京华大基因科技 股份有限公司合成。以 β-actin为内参对照。通过NCBI中Blast的同源比对功能, 评价设计的引物特异性。
| 表1 用于分析目标基因表达的引物序列 Table 1 Primer sequences for gene expression assay |
采用M-MLV Reverse Transcriptase试剂盒(Promega), 按操作指南合成第一链cDNA。反应总体积为20 µL, 包括Oligo dT (50 µmol L-1) 1 µL、总RNA (1 µg µL-1) 2 µL、dNTPs (10 mmol L-1) 4 µL、DEPC处理过的H2O 5.5 µL。
实时荧光PCR反应体系为50 µL, 包括10× buffer 5 µL、50 mmol L-1 MgC12 5 µL、10 mmol L-1 dNTP 2 µL、 Taq DNA聚合酶(2.5 U µL-1) 1 µL、上下游引物(400 µmol L-1)各0.2 µL、50×SYBR Green One 1 µL、cDNA 2 µL、H2O 33.6 µL。在Eppendorf Realplex4 Mastercycler Epgradient S中进行PCR反应, 反应条件为94℃ 5 min; 94℃ 15 s, 58℃ 30 s, 72℃ 30 s, 40个循环。在58℃反应步骤时收集荧光信号。每样品3个重复。根据扩增曲线确定每个基因相应的 Ct值, 以 β-actin为内对照校正PCR模板的拷贝数。采用2-ΔΔCt方法[18]计算相对量。
用SPSS10.0软件进行方差分析和显著性检验。分析表明, 农艺性状与淀粉含量两年度的总体变化趋势一致, 且供试材料与年度间不存在交互作用, 故本文采用2009年的农艺性状、淀粉含量、淀粉酶活性和基因表达数据进行分析。
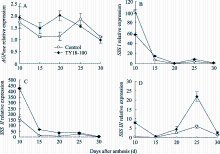
在灌浆过程中, 转基因株系与对照籽粒中 Trxh基因表达量均呈单峰曲线变化, 均在花后25 d达到峰值(图1)。在籽粒灌浆早期(花后10 d内), 2个转基因株系 Trxh表达量与未转基因对照差异较小, 但随着籽粒发育度增加转基因株系的表达量呈降低趋势, 花后15~25 d达显著差异( P<0.05), 说明外源 Trxs基因能够在转基因小麦中正常表达, 并直接干扰或抑制内源基因的表达。
 | 图1 转反义 Trxs基因小麦籽粒灌浆过程中 Trxh基因表达Fig. 1 Expression of Trxh during grain filling in anti- Trxs transgenic wheat lines |
与未转基因对照相比, 2个转基因株系的生育期、植株高度、单株成穗数和单株籽粒数均没有明显变化, 而千粒重和单株产量分别高18.2%和38.6%, 差异显著(表2)。2个转基因株系的产量水平存在差异, 单株产量分别较对照的增加29.8% (TY18-99)和47.4% (TY18-100)。
| 表2 转基因株系与对照农艺性状比较 Table 2 Comparison of agronomic traits between transgenic lines and their control |
在灌浆过程中, 小麦籽粒总淀粉与支链淀粉的积累速率呈相似变化规律(图2), 即均随灌浆进程逐渐加快, 到灌浆中期(开花后20~25 d)达峰值后逐渐下降, 且在开花后15~30 d显著或极显著高于对照。直链淀粉积累速率在灌浆期间也呈单峰曲线变化, 但峰值出现时间(开花后15~20 d)比总淀粉和支链淀粉积累速率早, 且在花后10~20 d与对照无明显差异, 但在25 d后较对照有所提高。表明, 反义 Trxs基因导入有利于总淀粉与支链淀粉的合成与积累。
2.4.1 AGPase活性 转基因株系和对照小麦籽粒中AGPase活性均随灌浆进程呈单峰曲线变化(图3-A)。对照峰值出现在开花后20 d, 而转基因株系的峰值出现在花后25 d, 且在峰值出现后, 2个转基因株系的AGPase活性分别比对照提高45.3% (TY18-99)和46.3% (TY18-100), 差异显著( P<0.01)。说明反义 Trxs基因导入对AGPase活性有一定的调控效应, 且主要发生在灌浆后期。
 | 图2 小麦籽粒灌浆过程中淀粉(A)、直链淀粉(B)和支链淀粉(C)积累速率的变化Fig. 2 Changes of starch (A), amylase (B), and amylopectin (C) accumulating rate during grain filling |
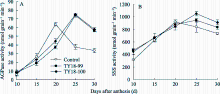 | 图3 小麦籽粒灌浆过程中AGPase (A)和SSS (B)活性的变化Fig. 3 Changes of AGPase (A) and SSS (B) activities during grain filling |
2.4.2 SSS活性 SSS活性的变化趋势与AGPase相似, 在小麦籽粒灌浆期呈单峰曲线变化, 未转基因小麦的峰值出现在开花后20 d, 而转基因株系的峰值较对照有所推迟, 出现在开花后25 d (图3-B)。与未转基因对照相比, 在灌浆前期(花后10~15 d)和灌浆后期(花后25~30 d), 2个转基因株系SSS活性均显著高于对照, 平均分别比对照提高24.6% (TY18-99)和19.0% (TY18-100)。说明反义 Trxs基因导入能够提高小麦籽粒灌浆前期和后期SSS活性, 有利于支链淀粉的合成与积累。
2.4.3 GBSS活性 GBSS活性开始灌浆时较低, 随灌浆进程逐渐提高, 并于开花后20 d达峰值后迅速下降。在峰值出现之前, 2个转基因株系的GBSS活性均高于对照, 达到峰值后, 2个转基因株系的GBSS活性均较对照有所降低(图4-A)。
2.4.4 SBE活性 在小麦籽粒灌浆期间, 未转基因对照SBE活性呈单峰曲线变化, 其峰值出现在开花后20 d, 而2个转基因株系的SBE活性表现为开始灌浆时较低, 以后随着灌浆进程呈逐渐增加的变化趋势(图4-B)。与未转基因对照相比, 在整个灌浆过程中, 2个转基因株系的SBE活性均高于对照, 分别提高44.8% (TY18-99)和52.8% (TY18-100), 且在花后15~30 d达显著差异( P<0.01)。
 | 图4 小麦籽粒灌浆过程中GBSS (A)和SBE (B)活性的变化Fig. 4 Changes of GBSS (A) and SBE (B) activities during grain filling |
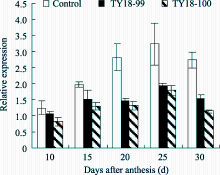
2.5.1 AGPase基因 在灌浆过程中, 转基因株系与对照籽粒中 AGPase的表达量均呈“降-升-降” 的变化趋势(图5-A)。在开花后10~20 d, 转基因株系 AGPase基因的表达量显著高于对照, 20 d后 AGPase的表达量较对照有所下降。说明反义 Trxs基因的导入对受体小麦 AGPase基因的表达有一定的调控作用且主要发生在籽粒灌浆前期和中期。
2.5.2 SSS基因 小麦籽粒中 SSS I基因的表达量随灌浆进程呈逐渐下降的变化趋势。在籽粒灌浆早期(花后10 d内), 转基因株系 SSS I的表达量明显低于对照, 但随着籽粒成熟度的增加表达量显著高于对照(图5-B)。
SSS II在小麦籽粒灌浆过程中的表达趋势与 SSS I基本一致, 即随灌浆进程呈逐渐下降的变化趋势(图5-C)。与 SSS I不同的是, 在整个灌浆过程中, 转基因株系 SSS II的表达量均明显高于对照, 且在花后10~20 d差异显著( P<0.01)。
与 SSS I和 SSS II不同, 在小麦籽粒灌浆过程中 SSS III的表达呈谷峰曲线变化, 谷值出现在花后15 d, 而峰值出现在花后25 d。在整个灌浆过程中, 转基因株系的表达均明显高于对照(图5-D)。在花后10、15和25 d, 转基因株系 SSS III的表达量分别为对照的30.7、25.3和3.7倍且均达显著差异( P<0.01)。说明反义 Trxs基因对 SSS III的调控作用明显大于其他2个基因。
2.5.3 GBSS I基因 小麦籽粒灌浆过程中 GBSS I表达呈单峰曲线变化, 其峰值出现在花后15 d。在花后10~20 d, 转基因株系 GBSS I的表达量显著低于对照, 此后随着灌浆进程, 转基因株系 GBSS I的表达量虽较对照有所增加但差异未达显著水平(图6-A)。说明反义 Trxs基因的导入对受体小麦 GBSS I的表达有一定的抑制作用且主要发生在籽粒灌浆前期和中期。
2.5.4 SBE I基因 在灌浆期间, 小麦籽粒中 SBE I表达呈“升-降-升”的变化趋势(图6-B)。在花后10~20 d, 转基因株系 SBE I的表达量均显著高于对
照, 此后随着籽粒的成熟, 转基因株系 SBE I的表达量较对照有所降低。说明反义 Trxs基因导入对受体小麦 SBE I基因的表达调控主要在籽粒灌浆前期和中期。
二硫键是决定酶三维构象和生理活性的重要因素之一, 其氧化还原状态直接或间接地影响着许多酶的活性。研究表明, Trxh在小麦种子发育过程中发挥着重要的调控作用, 它通过氧化还原二硫键参与营养物质从植株向种子的转移和储藏过程[19], 而这一时期正是小麦籽粒储藏物质合成与积累的重要阶段, 直接影响小麦的产量及品质。本研究中将反义 Trxs基因导入小麦后, 发现反义 Trxs基因表达后使原品种的产量结构发生了较大变化, 2个转基因株系的单株产量均显著提高。进一步对其在种子发育过程中的淀粉积累速率研究表明, 在小麦籽粒灌浆的中期和后期, 转基因株系的总淀粉与支链淀粉的积累速率加快, 表明反义 Trxs基因导入有利于籽粒中淀粉的积累, 从而使转基因小麦籽粒中储藏物质合成与积累量增加。该结果与课题组前期报道的抑制表达 Trxs的转基因小麦淀粉含量升高的研究结果相一致[11]。
转基因小麦在籽粒灌浆中期和后期的淀粉积累速率较高与其AGPase、SSS、GBSS和SBE活性较高密切关联。已有研究表明, 在小麦籽粒淀粉合成过程中, 由AGPase催化合成淀粉直接前体腺苷二磷酸葡萄糖(ADPG), 在SSS的催化作用下参与合成支链淀粉, 在GBSS的催化作用下参与合成直链淀粉, SBE催化分支糖链的产生[20,21,22]。AGPase、SSS和SBE的活性与总淀粉和支链淀粉积累速率呈正相关, GBSS的活性与直链淀粉积累速率呈正相 关[13,23]。本研究结果表明, 反义 Trxs基因导入可使小麦籽粒中SBE活性在整个籽粒形成过程中显著提高, AGPase和SSS活性在灌浆后期显著提高, 但在开花后20~30 d, GBSS的活性低于对照, 从而使籽粒灌浆期间的淀粉积累速率发生了改变, 最终显著提高了总淀粉和支链淀粉含量, 降低了直链淀粉含量, 进而提高了淀粉的支/直比, 改善了小麦淀粉品质。该结果与Trx能够促进淀粉的合成[4]和反义 Trxs基因导入有利于小麦淀粉品质改善[11]的报道相吻合。
目前, 对小麦淀粉合成关键酶基因已有一些研究。Reeves等[24]报道, AGPase基因在籽粒淀粉合成过程中主要通过转录水平来控制, 小麦籽粒胚乳发育过程中 AGPase基因的mRNA表达量与AGPase活性及淀粉积累速率呈正相关。Li等[25]研究发现, 抑制表达 GBSS I的转基因小麦籽粒胚乳中的GBSSI活性和直链淀粉含量明显下降。 SSS和 SBE基因发生突变或缺失, 籽粒中支链淀粉的合成受阻[26,27]。本试验结果表明, 反义 Trxs基因对小麦籽粒中 AGPase、 SSS和 GBSS I基因表达有一定的调控作用。在花后15~30 d, 转基因显著提高了小麦籽粒中 SSS I、 SSS II和 SSS III基因的mRNA相对表达量。在灌浆前期和中期, 显著提高了 AGPase和 SBE I基因的转录水平, 抑制了 GBSS I基因的表达。在花后10~20 d, 小麦籽粒中 AGPase、SSS III、 SBE I和 GBSSI基因表达水平与籽粒中淀粉及其组分积累速率几乎呈线性相关趋势, 且 AGPase、 SBE I和 GBSS I基因的转录峰值较相应酶活性峰值出现时间有所提前, 说明反义 Trxs基因主要通过调控 AGPase、 SSS、 SBE I和 GBSS I基因的时空表达水平来调控籽粒淀粉的合成。从小麦籽粒中淀粉合成酶活性与淀粉合成酶基因表达水平来看, 反义 Trxs基因对 SSS III基因调控主要发生在转录水平上, 对 AGPase、 SSS I、 SSS II、 SBE I和 GBSS I基因调控主要发生在转录后水平上。
关于Trxh的调控功能多集中于对种子萌发过程中的研究, 而对种子发育过程中的功能研究较少。最近有研究发现, Trxh是一个质膜相关蛋白, 它能够从原来表达的细胞迁移至另一个细胞来调控细胞间的氧化-还原动态平衡[28]。在前期研究中, 我们发现抑制表达 Trxh的转基因小麦籽粒中水解酶活性显著降低[10]。Guo等[29]对成熟期种子蛋白双向电泳分析表明, 反义 Trxs基因可作用于转录因子WRKY和代谢调节蛋白14-3-3, 调节小麦籽粒代谢。由此, 我们推测, 反义 Trxs基因表达可能抑制小麦内源硫氧还蛋白基因的表达, 影响小麦籽粒中原有的碳代谢平衡。反义 Trxs基因在抑制碳代谢途径中参与分解代谢的部分酶活性的同时, 也使得参与合成代谢的部分酶活性得以提高来维持细胞间的动态平衡, 可能是转基因小麦中部分淀粉合成酶基因表达量增加和酶活性提高的主要原因, 有关反义 Trxs基因调控小麦籽粒中淀粉合成关键酶基因的内在机制有待进一步研究。
反义 Trxs基因表达后显著提高受体小麦总淀粉与支链淀粉的灌浆速率; 提高籽粒中AGPase、SSS和SBE的活性, 降低GBSS的活性; 促进 AGPase、 SBE I、 SSS( SSS I、 SSS II和 SSS III)基因的转录水平, 抑制 GBSS I的表达。反义 Trxs基因对小麦籽粒灌浆的调控作用, 可能与 AGPase、 SBE I和 SSS表达增强有关。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|